Validación del sustrato y nutrición en los diferentes estados fenológicos de la planta de Cannabis sp
El auge del cultivo de cannabis en Colombia ha tomado un rumbo importante dentro del sector Agroindustrial, aportando desarrollo al sector y consolidándose como un cultivo que puede incrementar paulatinamente las áreas sembradas en nuestro país.
Durante el año 2018 la JIFE (Junta Internacional para la Fiscalización de Estupefacientes) le otorgó a Colombia un cupo del 44% de la producción autorizada a nivel global, que equivale a 40.5 ton de resina cruda para fines medicinales y científicos. (Angarita, 2018)
De cara a este potencial de mercado de exportación estimado en 11 billones de dólares y de 54 billones para el año 2025 (PROCOLOMBIA, 2018), Colombia es un país privilegiado dada su elevada oferta hídrica, diversidad de microclimas sin estaciones de invierno o verano extendido, donde se resalta la alta intensidad lumínica de 12 horas/día y 12 horas/noche que es benéfica para la etapa de floración, y amplio desarrollo del sector productor y exportador de flores (rosas y hortensias) y frutas (banano y aguacate).
Para ser un exportador de extracto de esta planta es importante cumplir con los más altos estándares de calidad internacionales en temas relacionados con: Contenido de Metales Pesados (Arsénico, Cadmio, Cromo, Plomo, Níquel y Mercurio), Control Fitosanitario y Microbiológico, Residuos de Plaguicidas y Potencia o Contenido de Cannabinoides CDB/THC/CBN (Fundación CANNA). Esto con el fin de evitar poner en riesgo la salud humana, debido a que gran parte de la extracción de la planta de cannabis (resina) está direccionado a la industria farmacéutica y alimenticia que tienen un destino final de consumo humano.
El cultivo de Cannabis medicinal en Colombia enfrenta los siguientes desafíos agronómicos: uso de suelo o sustrato, nutrición, densidad de siembra, luz, podas, manejo integrado de plagas, manejo integrado de enfermedades etc. que afectan la productividad, calidad y los costos de producción.
Dado que en algunas regiones de Colombia se están destinando suelos al establecimiento de este cultivo, es necesario contar con análisis físico-químicos y microbiológicos de suelo previos que permitan identificar factores limitantes como:
1. Microorganismos Fitopatógenos entre los cuales se resaltan hongos: Fusarium ssp, Phyptoptora ssp, Pythium ssp, Verticillium ssp, entre otros; bacterias: Pseudomonas ssp, Xanthomonas ssp, Ralstonia ssp, Erwinia ssp; nemátodos: Meloidogyne sp, Pratylenchus sp, Helycotylenchus sp, Criconema sp, etc. (Moreira, E.J, & D.E, 2012)
2. Presencia de metales pesados en el suelo debido a prácticas en el control MIPE (manejo integrado de plagas y enfermedades) y MIRFE (manejo integrado de riego y fertilización), que pueden generar acumulaciones de estos en la planta.
Estudios en biorremediación, señalan que la planta de cannabis sativa se considera una planta hiperacumuladora de metales pesados (J, C., Sánchez, & Medina-Vásquez, 2013), incluso la fundación CANNA resalta que es un planta utilizada en la fitorremediación por su alta afinidad de absorción a este tipo de compuestos (Fundación CANNA); por ende, entidades como la AHP “American Herbal Pharmacopeia” y USP “United States Pharmacopeia” regulan las concentraciones máximas permisibles de metales pesados en el producto, con el fin de evitar poner en riesgo la salud humana.
Para un aseguramiento de los factores mencionados anteriormente, es necesario tener en cuenta las prácticas ó métodos implementados en el cultivo para la obtención de flor seca o moño seco destinada a extracción y conversión en resina cruda de Cannabis; tanto así, que una posible solución es la hidroponía o el uso de sustratos que surge como una alternativa en esta industria.
Los métodos de cultivo de referencia internacional corresponden a plantaciones “indoor” hidropónicas bajo techo con sistemas de aire acondicionado, luz led para control de intensidad lumínica y duración de fotoperiodo, manejo de plagas y enfermedades, sembrando variedades modificadas genéticamente adaptadas a esas condiciones. Condiciones que son poco replicables y versátiles para el sector agrícola colombiano.
Es por esto que, en Dr. Calderón Asistencia Técnica Agrícola Ltda., se viene desarrollando tecnología apropiada de cultivo y servicios de asistencia técnica especializada dirigida al sector de Cannabis Medicinal Colombiano.
La presente investigación validó el uso del sustrato (cascarilla de arroz cruda + caolín), y su efecto en el desarrollo fenológico de una variedad desconocida de Cannabis sp, en este sustrato se realizaron mediciones de humedad empleando tensiómetros de manómetro y electrónico, igualmente se midió la resistividad eléctrica a granel del sustrato; esto con el fin, de llevar una bitácora de riego y así poder determinar los momentos adecuados para regar. Finalmente se realizó un análisis foliar para conocer el estado de suficiencia nutricional de las plantas sembradas, además se complementó con un análisis de metales pesados en esta misma matriz (Arsénico, Cadmio, Cromo, Plomo, Níquel y Mercurio), para verificar el cumplimiento de los niveles exigidos.
Objetivo general
- Validación de sustrato (cascarilla de arroz cruda + caolín) y dosis de fertilización en el desarrollo fenológico de la planta de cannabis sp, empleando fertilizantes líquidos hidropónicos y fertilizantes sólidos formulados a nivel de laboratorio.
Objetivos específicos - Establecer un criterio de riego a partir de la medición de Resistividad a Granel y su correlación con el contenido de humedad.
- Determinar los posibles niveles de suficiencia foliar de la planta de cannabis sp.
- Determinar niveles de metales pesados en a nivel foliar.
Metodología
En sustrato de cascarilla de arroz caolinizada se sembraron 6 plántulas de cannabis escogidas aleatoriamente de un semillero de germinación de 20 semillas, se desconoce la variedad o procedencia del material genético de las semillas empleadas; por tanto, para efectos prácticos del experimento se estudió los diferentes estados fenológicos: germinación, desarrollo vegetativo y etapa de floración en función del sano crecimiento y desarrollo de las plantas, asociado al sustrato y fertilización empleada.
Durante la germinación, como primer paso se realizó una desinfección de la semilla con hipoclorito al 5%, y posterior germinación hermética (caja plástica sellada) durante 8 días, posterior a esto, se obtuvo un semillero en donde duraron 1 mes, lo anterior con el fin de obtener variabilidad de plantas, en donde al azar se escogieron un grupo de estas con las mejores características visuales de raíz, área foliar y tamaño, para luego ser trasplantadas en el sustrato. Cabe aclarar que no se conoce la variedad, por ende, las semillas utilizadas son regulares, es decir que se pueden obtener plantas hembras y planta macho o inclusive hermafroditas.
El fin de escoger el sustrato de cascarilla de arroz cruda y adicionarle caolín es aumentar la retención de humedad y capilaridad de este, completando así las características ideales que debe tener un sustrato las cuales son: retención de humedad, aireación, estabilidad física, inerte químicamente, inerte biológicamente, optimo drenaje, capilaridad, liviano, de bajo costo y disponible o asequible en la zona.
El sustrato es una mezcla de cascarilla de arroz cruda + caolín con proporciones de: 80 L (aprox. 9 kg) de cascarilla de arroz cruda + 16 kg caolín + 22 L agua, para un volumen total de 80 L, este sustrato se depositó en 2 materas rectangulares de 28 x 48 x 30 cm de profundidad con drenaje, de capacidad de 40 litros en donde se sembraron 3 plantas por matera a una distancia entre ellas de 15 cm.
Durante la etapa temprana de crecimiento y posterior desarrollo vegetativo se proporcionó 18 horas luz/día (12 horas luz día + 6 horas luz artificial tipo LED de 30 w por cada caja) y 6 horas de oscuridad/día en esta etapa fenológica de la panta, esto por un periodo de 3 meses.
Al mes de estar trasplantado en sustrato se procede a realizar una observación para poder identificar las plantas hembras y plantas macho, que pudieron presentarse al utilizar semilla regular. Esto se hizo identificando los pistilos o estructuras sexuales femeninas, que se suelen desarrollar en la etapa temprana de crecimiento de la planta como unos filamentos blancos.
En la fertilización con fertilizante líquido se varió la dosis del riego entre ½ y 1 full fisiológico, su composición es:
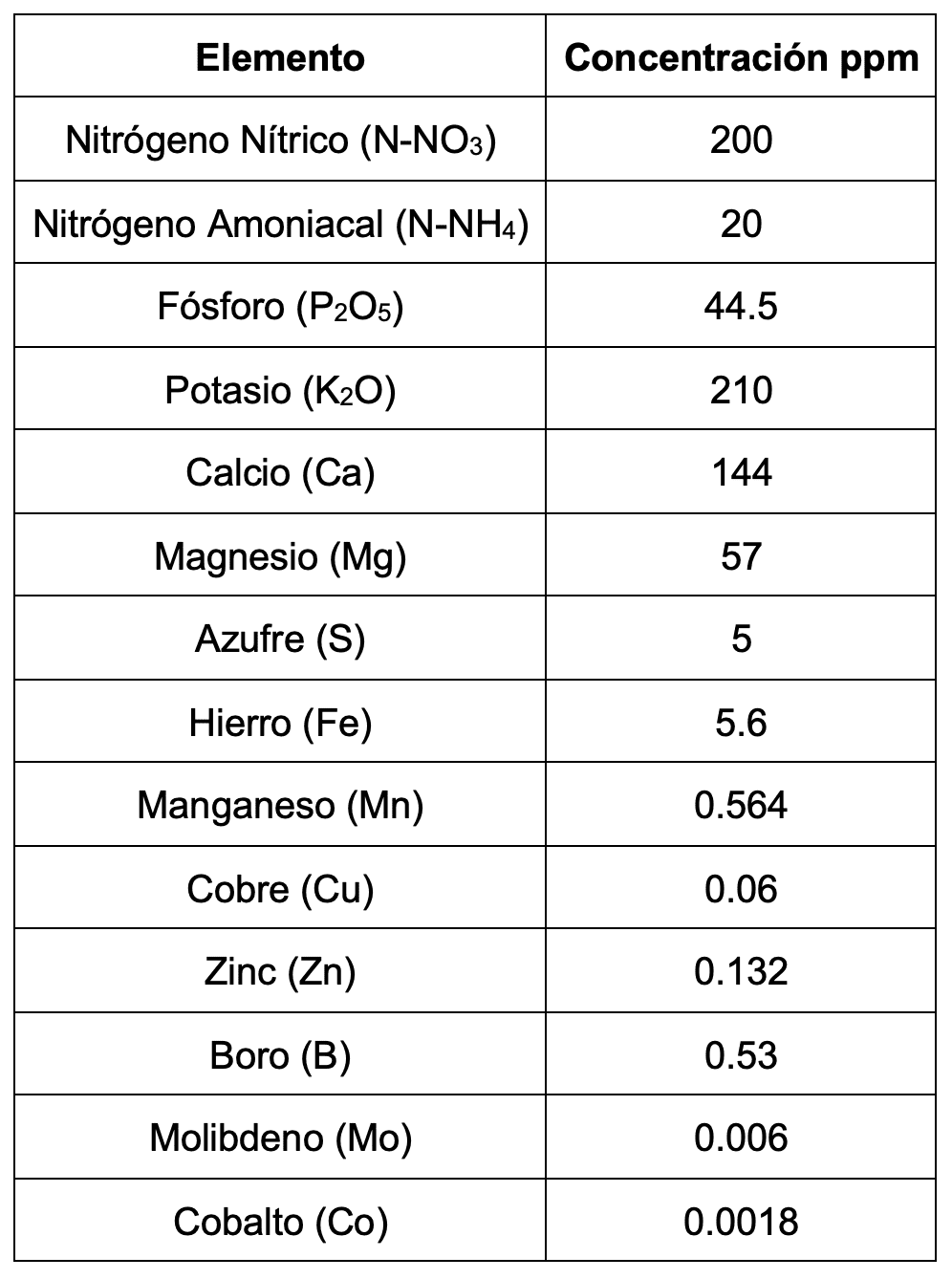
Tabla 1. Composición de la solución Nutritiva 1 F.
Se llevó un control de la Conductividad Eléctrica (C.E) del drenaje, para conocer el comportamiento que tengan las sales en el medio con el fin de regular el sustrato y no permitir que sea un medio Isotónico o Hipertónico; como criterio se aplicaba 1 full siempre y cuando la CE del drenaje fuera menor a 3 mS/cm (CANNA connection), cuando se observaba un aumento de la CE se disminuyó la concentración a ½ full.
Las plantas al momento de ser trasplantadas a sustrato duraron 4 semanas antes de iniciar el sistema de agobio o técnica SCROG “Screen of green”, con esto se logró combatir el fenómeno de dominancia apical generando un mayor engrosamiento del tallo principal y desarrollo de 12 a 16 brotes axilares/planta en su posterior desarrollo vegetativo.
Pasado 90 días después del trasplante se procedió a suspender la iluminación artificial de 6 horas/días, con el fin de brindar solamente 12 horas luz/día y 12 horas oscuridad/día para así poder inducir floración. El sistema de agobio tipo SCROG funciono perfecto, permitiendo un amplio desarrollo vegetativo de los brotes axilares a lo largo de todo el tallo principal de la planta.
A los 120 días se realizó una nueva modificación en la solución nutritiva aportando el siguiente fertilizante sólido 10-20-30, con el fin de aumentar la y robustecer las flores obtenidas.

Tabla 2.Composición fertilizante sólido 10-20-30.
En el trascurso de la investigación se realizaron seguimientos al estatus de humedad del sustrato con el fin de observar su comportamiento frente al crecimiento de las plantas, las mediciones se realizaron en primer lugar con tensiómetros de manómetro y con un instrumento desarrollado por Dr. Calderón Labs, para el caso de la Resistividad Eléctrica a granel (re), expresada en (Ω*m).
La resistividad es inversamente proporcional a la conductividad eléctrica y se relaciona directamente con la humedad y el contenido de sales del sustrato, es decir que a mayor humedad menor resistividad eléctrica y viceversa (Pandey, Shukla, & Habibi, 2015), esto permitió identificar los valores de humedad vía tensión y de resistividad que generaban marchitez en las plantas y por ende cuando se debía regar. Se realizó un estudio de análisis foliar o de suficiencia nutricional para comprobar los niveles de elementos mayores y menores, con el fin de identificar cualquier deficiencia nutricional.
Finalmente, con respecto a los parámetros de calidad claves, se analizó contenido de metales pesados y se comparó con los límites máximos permisibles en tejido vegetal de la norma internacional de la AHP “American Herbal Pharmacopeia”-NAC 453A (American Herbal Pharmacopoeia, 2018).
Todo lo anterior se llevó a cabo en las instalaciones de Dr. Calderón Labs, en un invernadero de vidrio aislado con condiciones controladas expuesto a las condiciones medioambientales de Bogotá D.C, a una temperatura y humedad relativa promedio de 30 °C y 21%.
Resultados
1. Germinación:
Recipiente hermético que permitió mantener las condiciones de humedad de un 95 % y una temperatura de 18°C con el fin de que a los 8 días pudiese generar la germinación de las semillas de cannabis, cabe aclarar que el porcentaje de germinación fue de un 60%. (Ver figuras 1 a 6).

Figura 1. Proceso de desinfección de las semillas utilizadas.

Figura 2. Siembra en cubos de espuma desinfectada en el módulo hermético.

Figura 3. Modulo lleno de agua para darle las condiciones de romper latencia. Humedad 98 %.

Figura 4. Germinación después de 8 días.

Figura 5. Semillero en solución nutritiva (Nutriponic)

Figura 6. Primer mes después de la germinación.
2. Preparación de Sustrato-Trasplante:
Sustrato de cascarilla de arroz cruda + caolín con proporciones de: 80 L de cascarilla + 16 kg caolín + 22 L agua, para un volumen total de 80 L, este sustrato se depositó en 2 materas con drenaje de capacidad de 40 L. El uso de este sustrato no generó problemas de plagas o enfermedades.

Figura 7. Preparación del sustrato y llenado de las materas.

Figura 8. Ubicación de electrodos para medición de resistividad eléctrica del sustrato.

Figura 9. Selección de las plántulas con mejores características de raíz, tamaño y área foliar.

Figura 10. Trasplante al sustrato.
3. Medición de Humedad y Resistividad Eléctrica:
Como resultado de las mediciones continuas de Humedad empleando el tensiómetro de manómetro y de Resistividad Eléctrica antes y después de cada riego, se concluye que el punto de marchitez se encuentra en valores de Humedad cercanos a 30-45 cm Hg (40-60 cBar) con una Resistividad Eléctrica entre 100-120 Ω*m; por encima de estos valores no se llevó el experimento debido a que se observó marchitez severa que podría llevar a las plantas a un punto de no retorno.
A continuación, se muestra el comportamiento de la Resistividad Eléctrica en ambas materas, la medición de resistividad se realizaba antes y después de cada riego diario. Por esto, las gráficas presentan valores máximos y mínimos; se aclara que cuando se encontraba saturado el sustrato después del riego con niveles de tensión de humedad de 0 cm Hg (0 cBar), la resistividad oscilo entre 30-50 Ω*m.

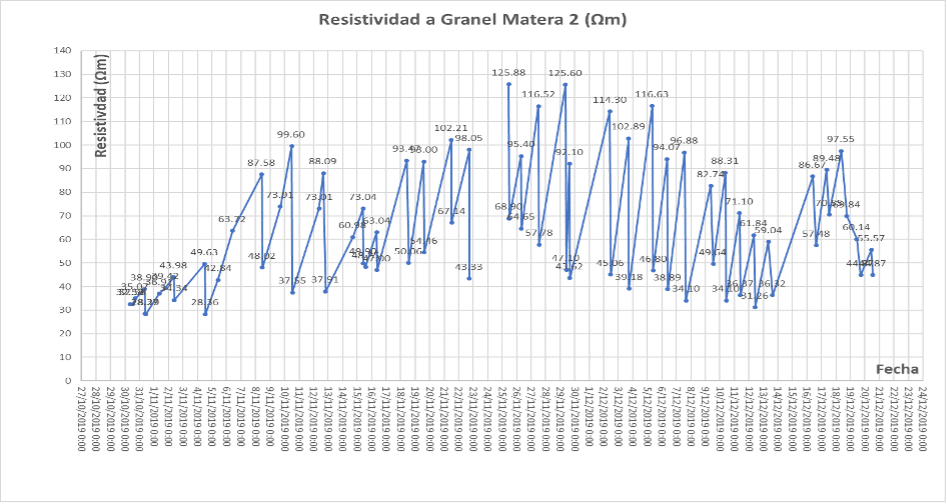
Gráfica 1. Medición de Resistividad Eléctrica en sustrato de cascarilla de arroz caolinizada, para las plantas de cannabis.
4. Sistema de Agobio tipo SCROG:
El sistema de agobio se montó al mes de estar las plantas trasplantadas en sustrato, y se mantuvo hasta el final del experimento. Como resultado se observó un gran desarrollo vegetativo de los brotes axilares de cada planta, desarrollando más de 12-16 brotes/planta.
Figura 11. Plantas con 1 mes de sembradas, antes de montar el agobio tipo SCROG.

Figura 12.Sistema de Agobio tipo SCROG.

Durante los 3 meses de crecimiento o desarrollo vegetativo y el mes de floración, las plantas alcanzaron una altura de 2.5-3m lo cual es característico del cannabis sativo.
Figura 13. Sistema de Agobio tipo SCROG, a los 4 meses de cultivo.


5. Identificación Sexualidad:
Al mes de estar sembradas en sustrato se pudieron observar en el tercio alto de las plantas flores femeninas (Pistilos) y las flores masculinas, esto concuerda con lo reportado por (Rosenthal, 2010).
Figura 13. Estructura sexual femenina o pistilo, en plantas de cannabis con 1 mes de siembra.

Figura 14. Estructura sexual masculina o estambre, en plantas de cannabis con 1 mes de siembra.

6. Análisis Foliar- Suficiencia Nutricional:
Para evaluar el estado de nutrición de las plantas de cannabis se determinó el contenido de los siguientes elementos: N, P, K, Ca, Mg, S, Fe, Mn, Cu, Zn, B, Na y Cl, a los 4 meses de estar sembrada en sustrato (durante la etapa de floración), ver tabla 3;
Se realizó un análisis a cada matera tomando hojas del tercio medio del crecimiento de los brotes laterales.
Tabla 3. Análisis Foliar Plantas de Cannabis (Doctor Calderón Asistencia Técnica Agrícola, 2020)
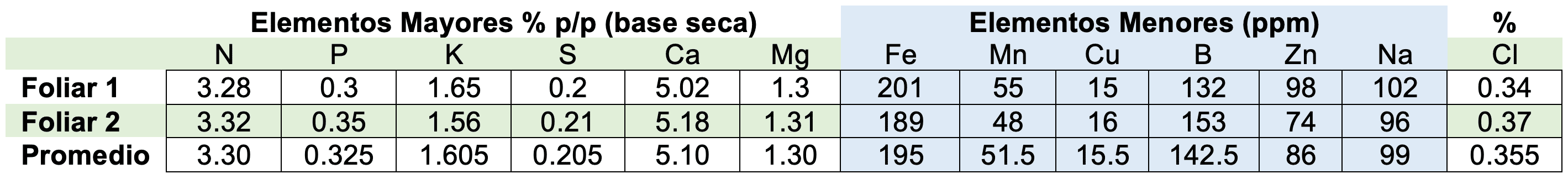
Datos de referencia de dos autores, frente a los resultados obtenidos en el análisis foliar, ver tabla 4 y 5:
Tabla 4. Estado de nutrientes de la planta de cáñamo, tomado de: (Iványi, 2011)
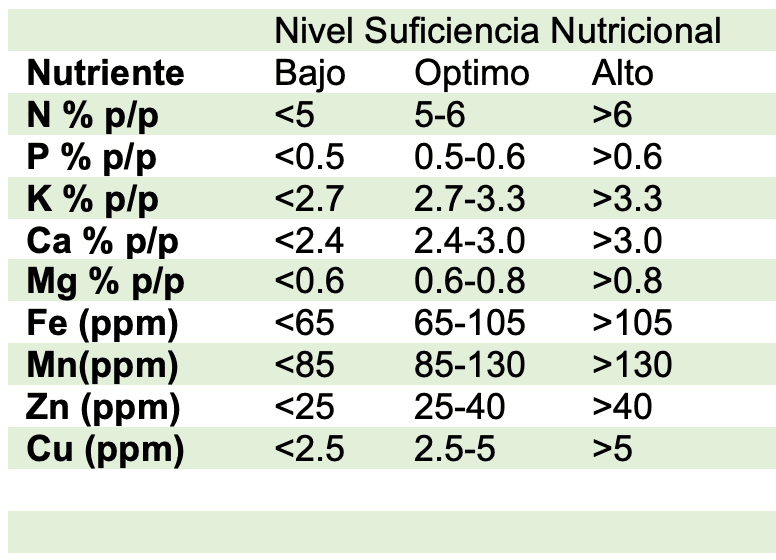
Tabla 5. Concentración de nutrientes en hoja de cannabis sativa, tomado de: (Bryson et al. 2014)

Tabla 6. Análisis Suficiencia Nutricional para las plantas de Cannabis sembradas, con respecto a cáñar

Con base en la referencia para cáñamo (Iványi, 2011), la variedad sembrada presenta niveles bajos de elementos mayores como N, P, K y menores como el Mn; no obstante, durante el desarrollo del experimento no se observó sintomatologías asociadas a deficiencias.
De la misma manera, se realizó la comparación con un estudio de caracterización de desórdenes nutricionales para cannabis sativa (Bryson, Mills, Sasseville, Jones, & Barker, 2014), ver tabla 7:
Tabla 7. Análisis Suficiencia Nutricional para las plantas de Cannabis sembradas, con respecto a Cannabis Sativa.
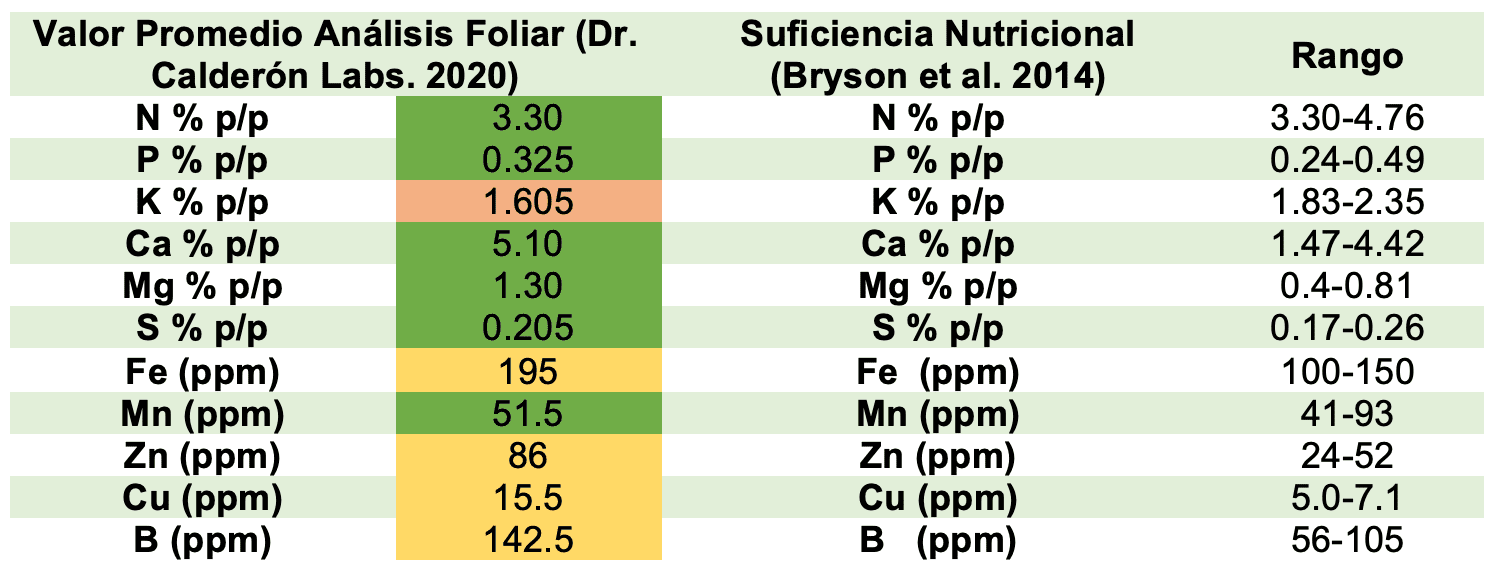
Esta última comparación representa una mayor correlación, en donde los niveles de elementos mayores como: N, P, Ca, Mg, S se encuentran dentro del rango catalogado como de suficiencia nutricional; salvo el K que tiene una leve deficiencia del 14%.
Por su parte, en elementos menores el Mn se encuentra dentro del rango, mientras que el Fe, Zn, Cu y B se encuentran en exceso en un: 30% ,65.4%, 118%, 35.7% respectivamente; sin embargo, no se evidencio cualquier efecto de toxicidad visual durante el crecimiento de las plantas.
7. Análisis Metales Pesados:
Los niveles máximos permisibles para cannabis o marihuana destinada a extracción acorde a la AHP “American Herbal Pharmacopeia”-NAC 453A (American Herbal Pharmacopoeia, 2018), se presentan en la tabla 8:
Tabla 8. Niveles máximo permisibles de metales pesados en material vegetal de cannabis para extracción, tomado de: (AHP, 2018)-NAC 453A.
*el Cromo y el Níquel, no tienen límites máximos permisibles dentro del capítulo 453 A de la AHP.

Se analizaron metales pesados a partir del tejido vegetal utilizado en el análisis foliar por medio de Espectroscopia de Adsorción Atómica ó AAS “Atomic Absorption Spectroscopy”, los resultados se presentan en la tabla 9:
Tabla 9. Análisis Metales Pesados Plantas de Cannabis (Doctor Calderón Asistencia Técnica Agrícola, 2020)
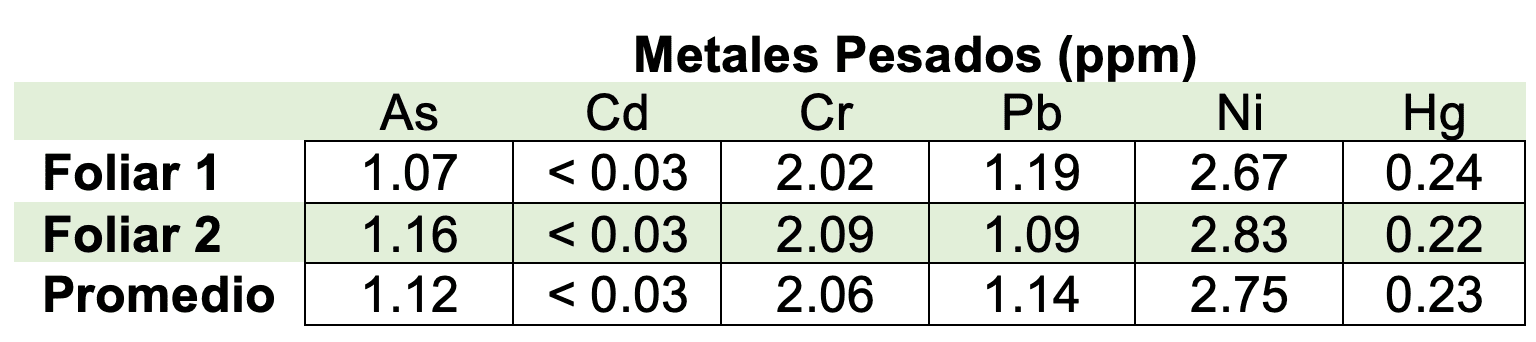
Los metales analizados corresponden a: Arsénico (As), Cadmio (Cd), Cromo (Cr), Plomo (Pb), Níquel (Ni) y Mercurio (Hg), estos niveles se compararon con los límites máximos permisibles en tejido vegetal destinado a la extracción según: (American Herbal Pharmacopoeia, 2018).
La concentración de los metales pesados analizados cumple con los estándares de la tabla 8; por tanto, este material vegetal se puede destinar a extracción o producción de resina. Esto implica que tanto el sustrato como la fertilización no contienen o aporta metales pesados en concentraciones apreciables o asimilables por las plantas sembradas.
En la investigación realizada, se observa la siguiente relación Ni>Pb>Cd que concuerda con lo reportado en un estudio de fitorremediación de suelos contaminados por metales pesados (Linger, Müssig, Fischer, & Kobert, 2002) lo cual demuestra su afinidad frente a la absorción por estos metales, en donde a nivel general, la máxima concentración se presenta en las hojas, además esta capacidad de bioadsorción depende ampliamente del pH del suelo o sustrato (Galic, Percin, Zgorelec, & Kisic, 2019); en este caso, la variable del pH no se tuvo en cuenta.
Conclusiones
El presente experimento es un primer acercamiento para poder consolidar una tecnología apropiada para el cultivo de cannabis, bajo el contexto colombiano con técnicas agronómicas asequibles que permitan al productor reducir costos de producción, incrementar la productividad y cumplir con los estándares de calidad mencionados.
El uso de sustrato de cascarilla de arroz cruda con caolín, tienen las siguientes ventajas: alto grado de capilaridad y retención de humedad, bajo costo e inocuidad hacia el crecimiento o desarrollo de microorganismos y de insectos o plagas (bajo costo de control fitosanitario de cultivo). En el contenido de humedad se evidenció que el punto de marchitez en plantas pequeñas (< 45 cm) se comenzó a presentar entre 30-45 cm Hg (40-60 cBar) lo cual permite tener un criterio frente a los niveles a los que la panta puede resistir y generar un buen manejo del recurso agua; en plantas de mayor tamaño (> 100 cm) la marchitez se presentó a menores tensiones de humedad, entre 20 y 30 cm Hg (26 a 40 cB) como punto de comparación, en el sector de rosas sembradas en suelo y de clavel en sustrato en la sabana de Bogotá, los niveles máximos de tensión para realizar el riego son del orden de 7.5-15 cm Hg (10-20 cBar).
Adicionalmente, para validar completamente el uso de este sustrato se tiene que realizar un análisis de metales pesados por medio de la técnica AAS “Atomic Absorption Spectroscopy”, ICP-OES e ICP-MS “Inductively coupled plasma mass spectrometry”.
El uso de estas tres técnicas de AAS, ICP-OES e ICP-MS para cuantificación de metales pesados es con fines comparativos y permitiría definir cuál de ellas es la más apropiada en la medición de la concentración de dichos elementos.
Uno de los enfoques en esta investigación es la nutrición, con el fin de identificar aquellos niveles de suficiencia que pueden dar una orientación del estado nutricional de esta planta. Esto se logró en las diferentes formulaciones empleadas y que en su desarrollo no se evidencio una deficiencia o toxicidad marcada de algún elemento.
El cumplimiento de los niveles máximos permitidos de metales pesados, valida la siembra de cannabis sp en sustrato de cascarilla de arroz cruda caolinizada junto a la solución de fertilización empleada. No obstante, se requiere una evaluación de productividad de resina cruda de cannabis frente al uso de otros sustratos hidropónicos o inclusive de siembra en suelo.
Finalmente, se concluye que el siguiente paso de esta investigación es sembrar una variedad plenamente identificada y caracterizada con fenotipo definido, esto con el fin de evaluar dicha información mediante un cultivo piloto de mayor escala, representativo de las condiciones reales de siembra del sector agroindustrial de cannabis, en donde se pueda llevar un control de: humedad, resistividad y conductividad eléctrica, fertilización, intensidad de luz, agobio o entutorado y trazabilidad de metales pesados en suelo o sustrato y demás insumos empleados. Igualmente se pueda evaluar la productividad y calidad del material obtenido.
Bibliografía
American Herbal Pharmacopoeia. (2018). The American Herbal Pharmacopoeia Cannabis Inflorescence, Standards of Identity, Analysis, and Quality Control, pursuant to NAC 453A. Retrieved from https://www.leg.state.nv.us/NAC/NAC-453A.html
Angarita, P. (2018, Enero 10). Colombia tiene 44 % del cupo mundial para cannabis medicinal. El Tiempo.
Bryson, G., Mills, H., Sasseville, D., Jones, J. J., & Barker, A. (2014). Plant Analysis Handbook III: A Guide to Sampling, Preparation, Analysis and Interpretation for Agronomic and Horticultural Crops. Athens, Georgia: Micro-Macro Publishing Inc.
CANNA connection. (n.d.). The ideal EC range for cannabis plants. Retrieved from https://www.cannaconnection.com/blog/1903-ideal-ec-range-plants
Fundación CANNA. (n.d.). Análisis de Metales Pesados. Retrieved from https://www.fundacion-canna.es/analisis-de-metales-pesados
Fundación CANNA. (n.d.). Hacia una mejor calidad de los productos cannabinoides. Retrieved from https://www.fundacion-canna.es/hacia-una-mejor-calidad-de-los-productos-cannabinoides
Galic, M., Percin, A., Zgorelec, Z., & Kisic, I. (2019). Evaluation of heavy metals accumulation potential of hemp (Cannabis sativa L.). Journal of Central European Agriculture.
Iványi, I. (2011). Relationship Between Leaf Nutrient Concentrations and Yield of Fibre Hemp (Cannabis Sativa L.). Research Journal of Agricultural Science.
J, P.-S. E., C. A.-P., Sánchez, J., & Medina-Vásquez, J. (2013). Bioprospección de plantas nativas para su uso en procesos de biorremediación: caso Helicona psittacorum (heliconiaceae). Revista de la Academia Colombiana de Ciencias Exactas, Físicas y Naturales, 472-473.
Linger, P., Müssig, J., Fischer, H., & Kobert, J. (2002). Industrial hemp (Cannabis sativa L.) growing on heavy metal contaminated soil: fibre quality and phytoremediation potential. Industrial Crops and Products an International Journal.
Moreira, F., E.J, H., & D.E, B. (2012). Manual de Biología de Suelos Tropicales. Muestreo y caracterización de la biodiversidad bajo suelo. México: Instituto Nacional de Ecología.
Pandey, L., Shukla, S., & Habibi, D. (2015). Electrical resistivity of sandy soil. Géotechnique Letters.
PROCOLOMBIA. (2018). Industria del Cannabis en Colombia. Bogotá D.C.
Rosenthal, E. (2010). Marijuana grower’s handbook. Oakland, California: Quick American Publishing.
